/article/300/30012.png?access_token=be933d0d-eea0-4808-b93a-5fe1c64e9ddd" style="outline: none; padding: 0px; margin: 0px; border: 0px; max-width: 100%; height: auto;">
图12.电泳缓冲液对电泳的影响。(A) 在电泳过程中,凝胶的顶部部分未被浸没。(B) 在低于推荐浓度的盐浓度缓冲液中运行凝胶(与凝胶制备中使用的缓冲液不同)。
注意,变性琼脂糖的电泳缓冲液可能既不是TAE,也不是TBE,因为这些凝胶可能在不同的缓冲液中制备,如磷酸钠和MOPS。选择与所用凝胶兼容的电泳缓冲液非常重要(图12B)。
b.电压
采用恒定电压、电流或功率通过凝胶,施加电势,开始运行凝胶。核酸电泳中常用恒压,一般为5–10 V/cm。
施加的电压(V)=电极间的距离(cm)x建议V/cm
可根据需要分离的DN**段的大小调整电压,也可以根据所使用的电泳缓冲液的类型进行调整(表 8)。市售核酸分子量标准通常提供建议电压,以便每个产品片段实现最佳分离。注意,电压极低会减缓核酸的迁移,从而导致小分子的扩散和分辨率过低(图13A)。另一方面,电压过高,会导致较差的分离效果和样品污点;有时,还会造成缓冲液过热,“微笑型条带”,甚至是样品变性(图13B)。
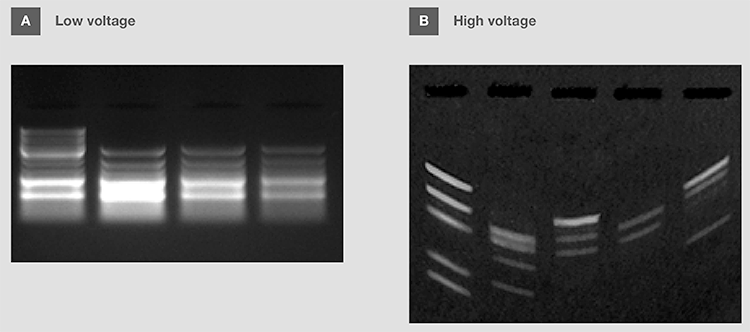
图13. 电压对DNA电泳的影响。 (A)低电压导致条带分辨率差和扩散。 (B)高电压导致“微笑型条带”。

某些情况下,可将温度探头连接至凝胶装置,以帮助控制缓冲液的冷却和加热。 电泳运行>2小时,缓冲液的冷却和再循环可改善样品分离。变性凝胶允许缓冲液加热至55°C,从而改善核酸单链形式,提升实验结果。
c.运行时间
凝胶长度、所用电压和样品中的分子大小决定电泳所需的时间。通常,电泳会持续到目的条带迁移至凝胶长度的40-60%。凝胶运行的特定时间,可观察到上样染料的相对位置,直至溴酚蓝染料已迁移约60%的凝胶长度和/或橙G染料已迁移80%的凝胶长度。此外,应监测运行时间,以确保样品或标准品中最小的分子不移出凝胶。注意,运行时间过短则不能完全分辨条带(图14)。含有示踪染料的DNA分子量标准可协助监测凝胶的运行,同时也可确保条带不被染料所遮盖。
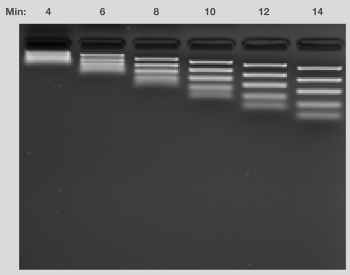
图14.运行时间对样品分离的影响。
4.在凝胶中可视化样品
凝胶运行完成后,需对样品进行可视化分析。由于普通照明环境下,核酸不可见,因此需要一种可视化的检测方法。如表9所述,可用方法在样品检测中,提供了不同的灵敏度和增益范围[6]。
a.荧光染色
现有的染色剂中,因荧光染料易于使用,灵敏度高,所以在样品检测中应用最为广泛(图15)。 当用适当波长激发时,染料发出可见光(即,荧光)。荧光强度与其和核酸结合的数量有关—这是检测和定量测定电泳中核酸的基础。
图15.不同类型的核酸结合染料。
溴化乙锭(EtBr) 染色时间短(约30分钟),灵敏度高(可检测到1 ng双链DNA/条带),为核酸电泳中的常用荧光染料。还可考虑另一种染料,原因如下:
诱变和处置: 溴化乙锭是高度诱变剂,所以荧光染料的 危险性较小,无需特殊处理,在核酸电泳中可提供安全工作流程(图16)。
灵敏度:灵敏度高于EtBr的荧光染料,适合检测少量样品(图16)。 因为有较少的碱基堆积,单链核酸的可视化通常需要更多样品和/或嵌入染料。 因此, 优先结合单链核酸的染料是RNA电泳样品检测的最佳选择。
紫外线损害:可用低能量蓝光(而非紫外光)来激发的荧光染料对核酸结构损伤较小,其灵敏度(图17A)不仅相同,甚至更高。 因此,电泳中使用蓝光激发可提高下游的成功应用,如克隆和测序(图17B)。

图16.特性增强的溴化乙锭替代品
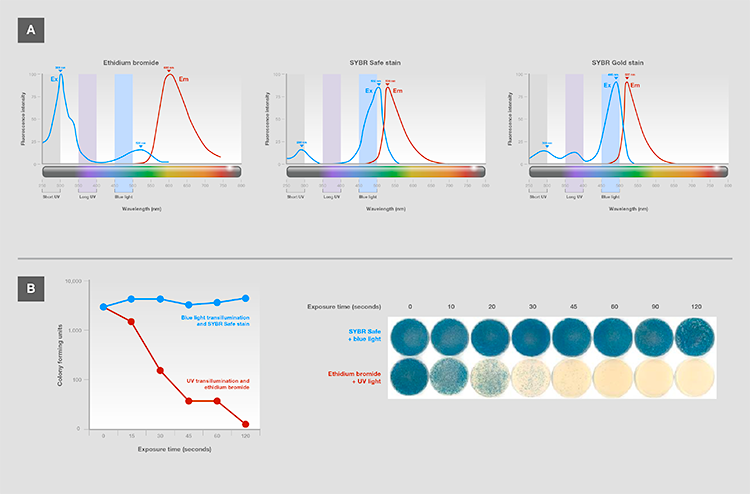
图17.(A)常见核酸染色的激发和发射光谱。最有效的波长被称为激发极大值。SYBR安全与SYBR金染料通过蓝光和较低的紫外光可最大程度激发。(B)用蓝光(针对SYBR安全染料)或紫外光(溴化乙锭)后的克隆效率,用于在电泳过程中显示克隆插入。用x-Gal培养皿上形成的蓝色菌落数量来衡量胶-纯化lacZ片段的克隆效率,其表明已将功能(未突变的)基因插入到载体中。
b.紫外阴影
在染料染色处,可通过称作紫外阴影的方法间接观察核酸,利用核酸[8]来吸收紫外线。该方法通常用于通过电泳分离和纯化寡核苷酸和RNA,这种情况下,简单检测已足够,和/或使用嵌入染料会影响下游的应用。为通过紫外阴影进行检测,需要纳克到微克的样品,并使用薄而透明的凝胶(如聚丙烯酰胺)以确保紫外线的吸收和透射。紫外阴影方法中,电泳后将凝胶从盒中取出(以便最大程度检测),用透明的塑料薄膜包裹后放置在UV-荧光薄层色谱板上。当凝胶至于紫外线辐射下时,核酸条带的吸收会在TLC板上投射阴影(图18)。将所需大小凝胶的阴影部分剪去,以作进一步处理。
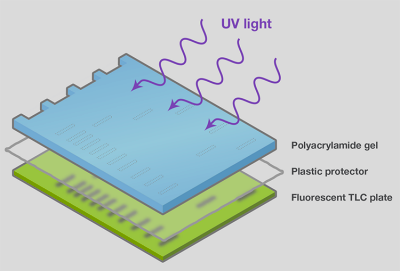
图18.紫外阴影使分离的片段显象。
5.记录凝胶
a.荧光成像技术
可视化后,核酸凝胶通常被存档记录下来,用于记录和分析电泳结果。如果样品被荧光染料染色,需特殊设备以适当的光源激发染料,使其显象并捕捉凝胶图像。激发光源在凝胶上,称为反射照明器(类似于手持式紫外线灯),或在凝胶下,称为透照器 (图19)。由于反射照明器上的光源位置较远,所以样品收到的能量较少。这样可以减少紫外线对核酸的损害,但也会降低凝胶条带的信号。另一方面,透照器可为条带提供更高的信号,但由于辐射接近凝胶,会增加紫外线造成的伤害。
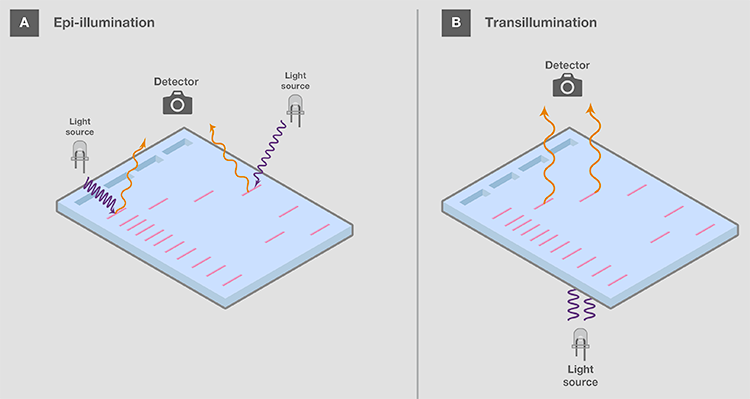
图19.反射照明器和透照器。
b.放射自显影法
在放射性核酸的电泳过程中,凝胶电泳后会暴露在x射线胶片上,这一过程即称为 放射自显影法。条带辐射的强度可用光密度测定来定量。
综上所述,核酸电泳工作流程采用多种步骤和试剂来分离和分析样品。为您的样品选择合适工具,并识别工作流程的优缺点,可显著提高分子生物学应用的电泳结果。
参考文献
1.Stellwagen NC (1998) DNA Gel Electrophoresis. In: Tietz D (editor), Nucleic Acid Electrophoresis (Springer Lab Manual). Heidelberg: Springer. pp 1–53.
2.Green MR, Sambrook J (2012) Analysis of DNA. In: Molecular Cloning: A Laboratory Manual (4th ed). Cold Spring Harbor: Cold Spring Harbor Laboratory Press. pp 81–156.
3.Yilmaz M, Ozic C, Gok I (2012) Principles of Nucleic Acid Separation by Agarose Gel Electrophoresis. In: Magdeldin S (editor), Gel Electrophoresis: Principles and Basics. Rijeka: InTech. pp 33–40.
4.Lee SV, Bahaman AR (2012) Discriminatory Power of Agarose Gel Electrophoresis in DNA Fragments Analysis. In: Magdeldin S (editor), Gel Electrophoresis: Principles and Basics. Rijeka: InTech. pp 41–56.
5.Barril P, Nates Silivia (2012) Introduction to Agarose and Polyacrylamide Gel Electrophoresis Matrices with Respect to their Detection Sensitivities. In: Magdeldin S (editor), Gel Electrophoresis: Principles and Basics. Rijeka: InTech. pp 3–14.
6.Thermo Fisher Scientific Inc (2010) Nucleic Acid Detection and Analysis. In: Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. pp 349–360.
7.Brody JR, Kern SE (2004) History and principles of conductive media for standard DNA electrophoresis. Anal Biochem 333(1):1–13.
8.Hassur SM, Whitlock HW Jr (1974) UV shadowing--a new and convenient method for the location of ultraviolet-absorbing species in polyacrylamide gels. Anal Biochem 59(1):162–164.
凝胶电泳是许多分子生物学实验的重要部分。建立核酸电泳需采取一系列步骤来实现核酸样品的最佳分离和分析。核酸凝胶电泳工作流程中的关键步骤包括:
1.选择和制备凝胶
a.琼脂糖凝胶 b.聚丙烯酰胺凝胶 c.凝胶制备中的缓冲液选择
2.准备标准品和样品
a.核酸梯度选择 b.样品和梯度准备 c.加载染料和缓冲液选择
3.运行电泳
a.电泳缓冲选择 b.电压 c.电泳时间
4.在凝胶中可视化样品
a.荧光染色 b.紫外阴影
5.记录凝胶
a.荧光成像 b.射线自显迹法
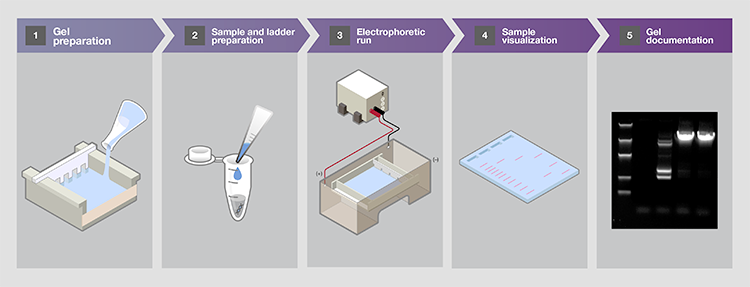
图1.核酸凝胶电泳的5大关键步骤。
1.选择和制备凝胶
琼脂糖(9012-36-6)和聚丙烯酰胺(9003-05-8)是核酸分离中最常用的两种凝胶基质。两种材料都是三维基质,孔径大小适合核酸分离,且与样品间无反应。可通过改变基质的百分比来调整孔径大小,从而有效分离不同大小的核酸。
有关琼脂糖凝胶和聚丙烯酰胺之间的选择,主要取决于核酸样品的大小和所希望达到的分辨率,虽然凝胶灌制和样品回收的方法也可考虑(表1)。琼脂糖凝胶的孔径大小非常理想,可分离0.1-25 kb范围内的核酸分子。聚丙烯酰胺形成的孔径较小,可用于分离小于1 kb的核酸分子。某些情况下,可采用聚丙烯酰胺凝胶以获得片段小于100bp的单碱基分辨率[1]。

a.琼脂糖凝胶
关于凝胶制备,琼脂糖凝胶通常以粉末形式提供,近年来也有方便的预称重片可供使用。为简化工作流程、节省时间,可考虑预制琼脂糖凝胶,其在某些 市售系统中作为集成单元来运行、可视化和分析。
制备您自己的琼脂糖凝胶,凝胶比例计算为:
凝胶%(w/v)=(琼脂糖g/缓冲液ml)x 100%
凝胶灌制时,如果使用了荧光核酸染色剂(溴化乙锭1239-45-8),可在凝胶灌制时加入推荐浓度(例如,溴化乙锭0.5 μg/mL)。
表2为不同长度的DN**段分离提供了推荐的琼脂糖凝胶百分比[2]。一般而言,较高比例的凝胶便于更小片段、更好的分离和分辨(图2)。注意,低比例凝胶十分脆弱且难以操作,而高比例凝胶则较浑浊,且会干扰可视化。
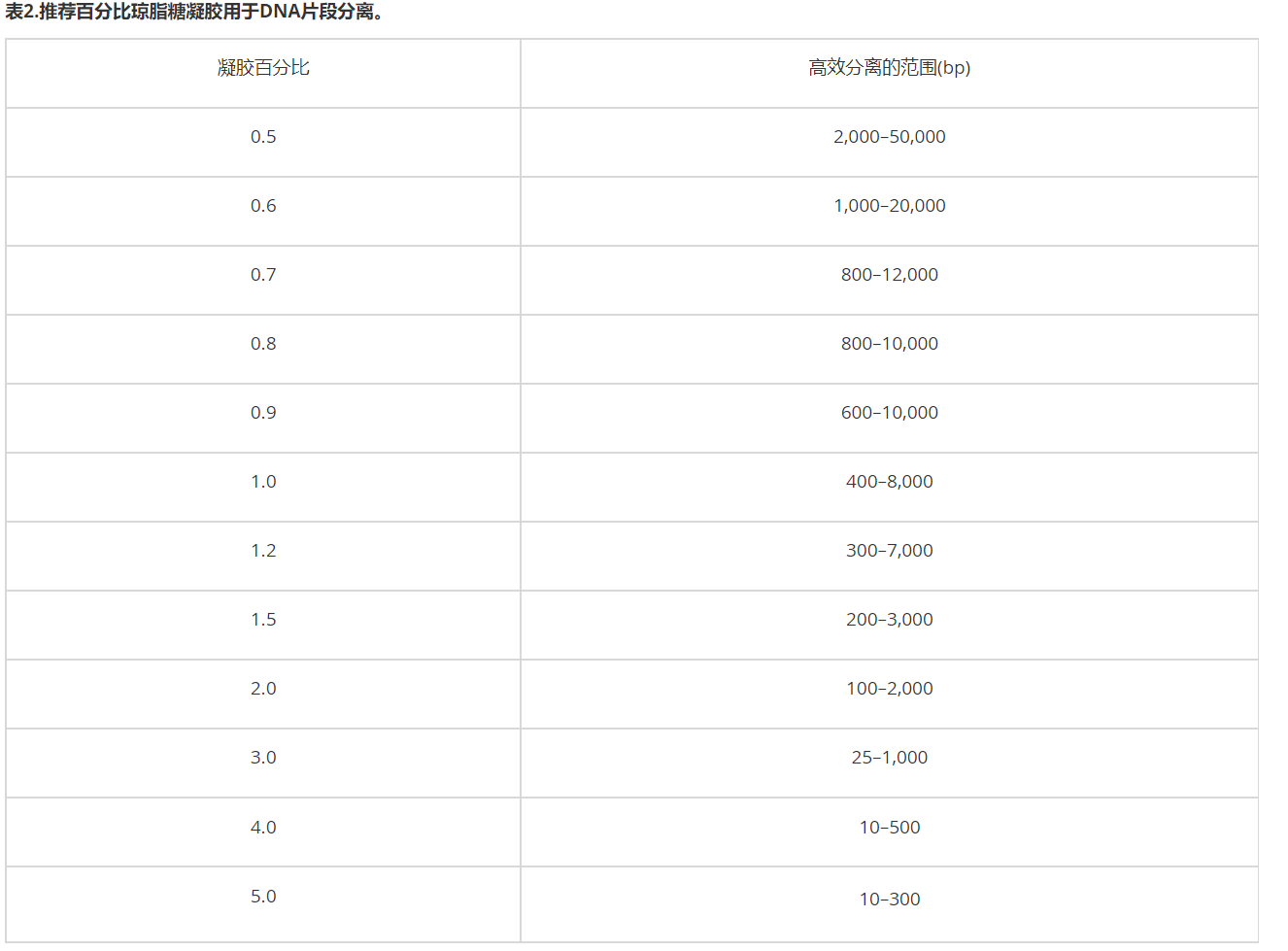
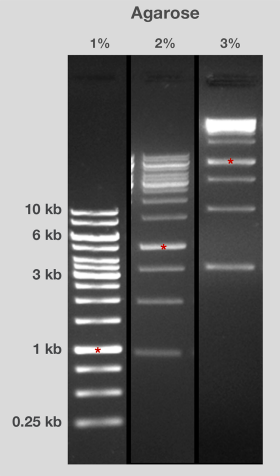
图2.不同百分比的琼脂糖凝胶中DN**段的流动性。在相同条件下(包括运行时间),在1%、2%和3%琼脂糖凝胶上分离出相同的DNA阶梯。1kb片段用红色星号表示,以供比较。
琼脂糖成分
琼脂糖是一种经过纯化的琼脂,是海洋红藻细胞壁的碳水化合物结构组成部分。 琼脂糖是一种分子量约为12万的无支链(线性)聚合物,含有800-1000个单糖。 琼脂糖链由一种重复的异二糖-即-D-半乳糖和3,6-酐-α-L-半乳糖通过1-4糖苷键结合而成。 双糖单位,也称琼脂二糖,通过a-1、3连接形成了一个链(图3)。
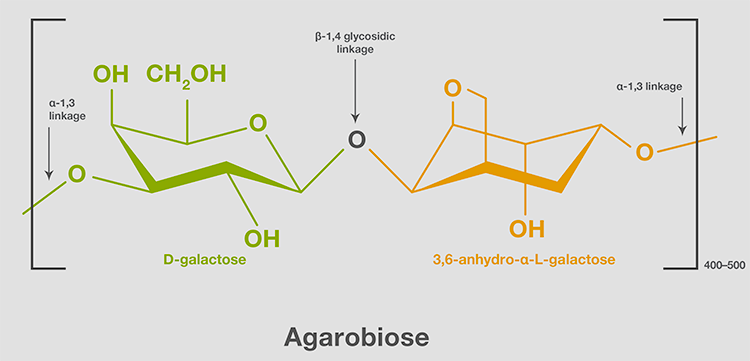
图3.琼脂糖的结构单元。琼脂糖由400-500个琼脂二糖单位组成。
琼脂糖溶液加热并冷却后,就会形成凝胶基质。其孔洞直径从50到200纳米不等,由凝胶浓度控制。温度高于90℃,琼脂糖便会融化,变成无规卷曲。冷却后,两个琼脂糖链形成由氢键连接的螺旋纤维。进一步冷却至胶凝固点以下(通常小于40°C),则会有更多氢键连接形成螺旋束网络,进而形成具有三维网格的凝胶(图4)[3,4]。 由于氢键,琼脂糖形成的凝胶加热可逆。因此,通过溶解含有目的片段的凝胶,可提取电泳分离出的核酸。
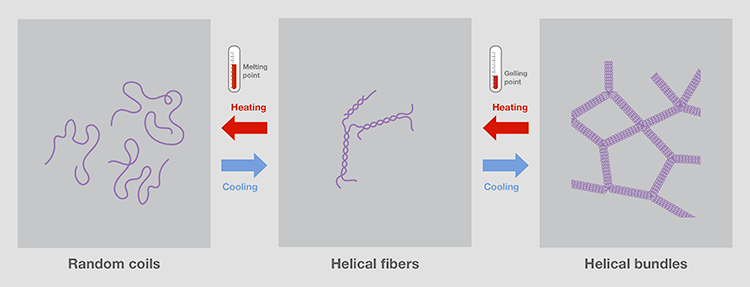
图4.通过加热和冷却改变溶液中琼脂糖的结构。
对大于10kbp DNA的提取,低熔点(LMP)的琼脂糖是较合适的选择。LMP琼脂糖在65度左右(1%的凝胶)融化—相对较低的温度,确保可以温和地提取凝胶中完整的核酸大分子。 LMP琼脂糖的低凝胶温度(~25°C)使其成为凝胶内酶反应的理想选择(例如,连接)。酶在半固态的琼脂溶液中处于活跃状态。
b.聚丙烯酰胺凝胶
聚丙烯酰胺-丙烯酰胺和交联剂—双丙烯酰胺(简称为“bis”)的组分-可以粉末形式提供,但为了方便通常预先制备成原液。该粉末和液体形式是为大家所知的神经毒素,应使用实验室防护性设施,小心操作。在凝胶中,丙烯酰胺和双丙烯酰胺(以%T表示)的总浓度决定了孔隙大小—通常直径为20-150纳米。百分比越高,孔隙越小,可分辨的分子也更小。表3展示了常用的凝胶比例[2]。
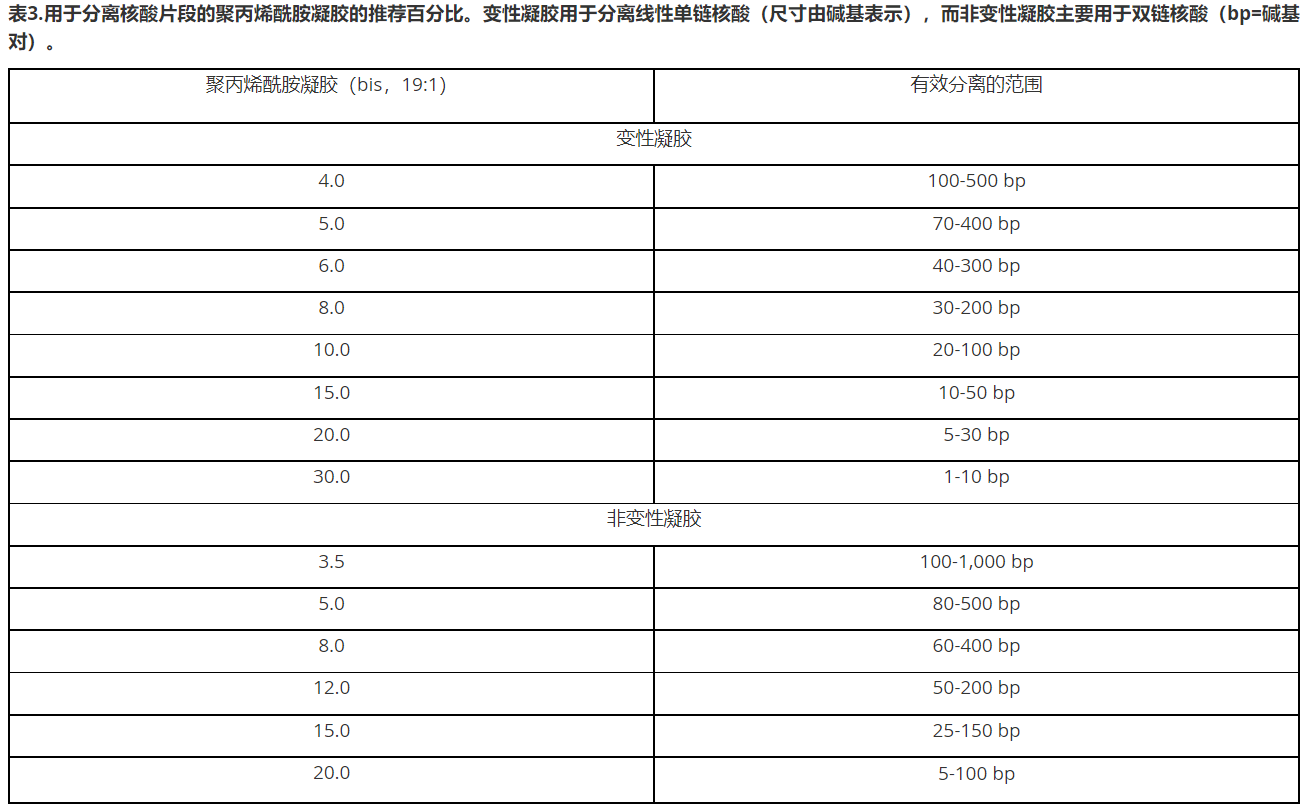
核酸分离,通常采用3–30%(%T)的聚丙烯酰胺凝胶。除%T之外,双丙烯酰胺(交联剂)与总丙烯酰胺(%C)的重量百分比是聚丙烯酰胺凝胶孔隙大小和样品分离的的关键(表4)。
%T和%C可以表示为:
%T(w/v)=[(丙烯酰胺+双丙烯酰胺)g/缓冲液ml]x 100%
%C(w/w)=[双丙烯酰胺g/(丙烯酰胺+双丙烯酰胺)g]x 100%
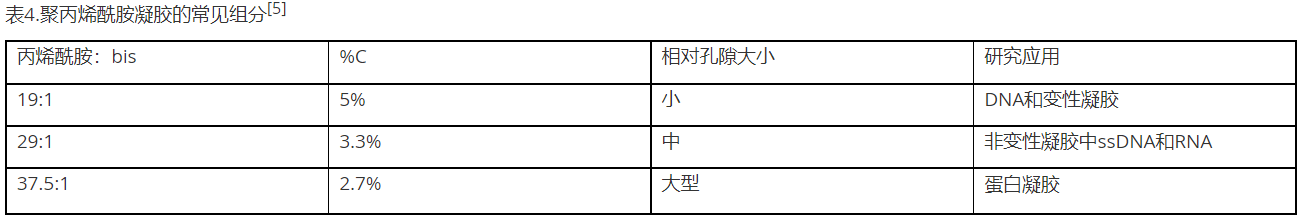
聚丙烯酰胺的基本原理
聚丙烯酰胺是由丙烯酰胺单体聚合而成的聚合物,通常与双丙烯酰胺或N,N'-亚甲基双丙烯酰胺结合使用。交联剂双丙烯酰胺含有两个单位通过亚甲基桥连的丙烯酰胺。聚合是被TEMED 催化(N,N,N′,N′-四甲基乙二胺)的自由基反应-通常由过硫酸铵(APS)引发(图 5)。因此,在既定温度下,APS和/或TEMED的浓度决定了聚合速率。
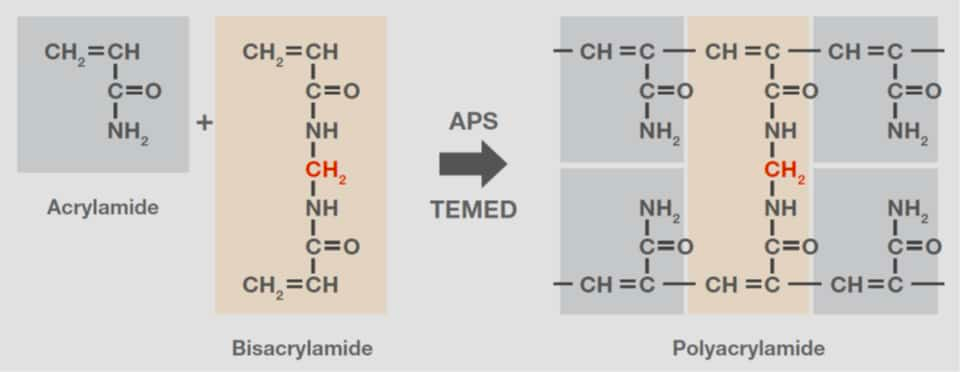
图5.丙烯酰胺形成聚丙烯酰胺,双丙烯酰胺结构展示。双丙烯酰胺含有两个单位通过亚甲基桥连的丙烯酰胺(红色)。
c.凝胶制备中的缓冲液选择
使用具有导电性的离子溶液制备琼脂糖和聚丙烯酰胺凝胶,确保核酸在电泳过程中具有迁移性。电泳过程中,凝胶和电泳缓冲液通常使用相同类型的缓冲液,以保持相同的pH值和离子强度。核酸电泳常用的两种缓冲液为Tris-醋酸盐EDTA (TAE)和Tris-硼酸盐EDTA (TBE),两者都有接近中性的pH值,有利于带负电荷的核酸。
为分析单链DNA或RNA,琼脂糖和聚丙烯酰胺凝胶通常在变性条件下制备和运行。变性条件会破坏核酸之间形成的氢键,从而减少像发夹环这样二级结构的形成。因此对RNA分离和分析而言,变性电泳更常用。琼脂糖和聚丙烯酰胺凝胶核酸电泳中常用的变性缓冲液包括:
琼脂糖:磷酸钠缓冲液中的乙二醛和DMSO、NaOH-EDTA缓冲液、MOPS缓冲液中的甲醛或甲酰胺等
聚丙烯酰胺: TBE缓冲液中的尿素
2.准备标准品和样品
a.核酸标准品选择
当运行凝胶时,含有已知大小的核酸参照样品通常被称为标准品、标记或 分子量标准,用于目的样品大小的估计。 在为给定样品选择合适的分子量标准时,需考虑如下因素:
Ladde类型(例如DNA或RNA),片段结构(例如单链或双链),构象(例如超螺旋、开环或线性)以确保对迁移进行适当比较
片段的数量和适当的分离形式,用于大小的估计
预期用途,如分子量标准是设计用于定性分析还是精确的定量测定
不同类型凝胶适用的分子量标准(例如,部分预制凝胶推荐设计 特定分子量标准以获得最佳运行结果)
上样染料的性质,避免目的条带模糊(图6)
上样缓冲液与使用凝胶的兼容性(例如,缓冲液的盐浓度会影响样品的迁移)
早期,DNA的大小标准主要来源于病毒基因组片段((例如,λφX174)和细菌质粒(如pUC19)的限制内切。该标准物在内切、样品纯度和电泳中带型的重现性方面存在问题。而后,从连接反应和/或PCR中获取的含有片段的分子量标准,因具有再现性且可产生预期大小的片段,而备受青睐。如今,因为色谱纯化片段实现了质量、带型、强度和数量等方面的更高控制,被视为分子量标准黄金标准(图6)。
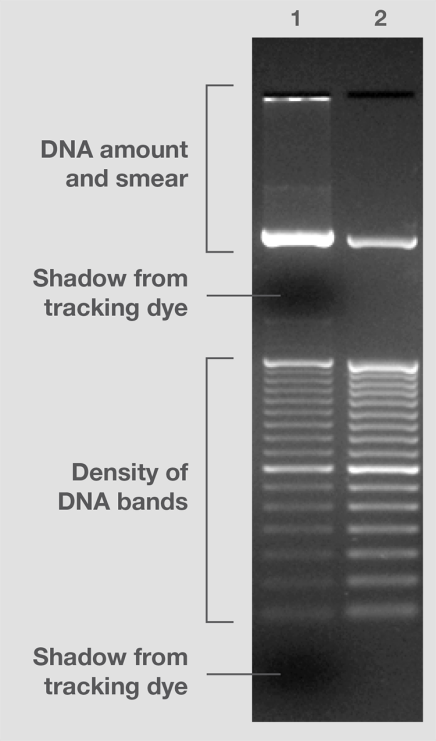
图6.DNA 分子量标准差异。 分子量标准 #2由色谱纯化的DN**段组成,存在于上佳的上样缓冲液中,可产生相等或预期强度的条带,并且不含有条带污



















