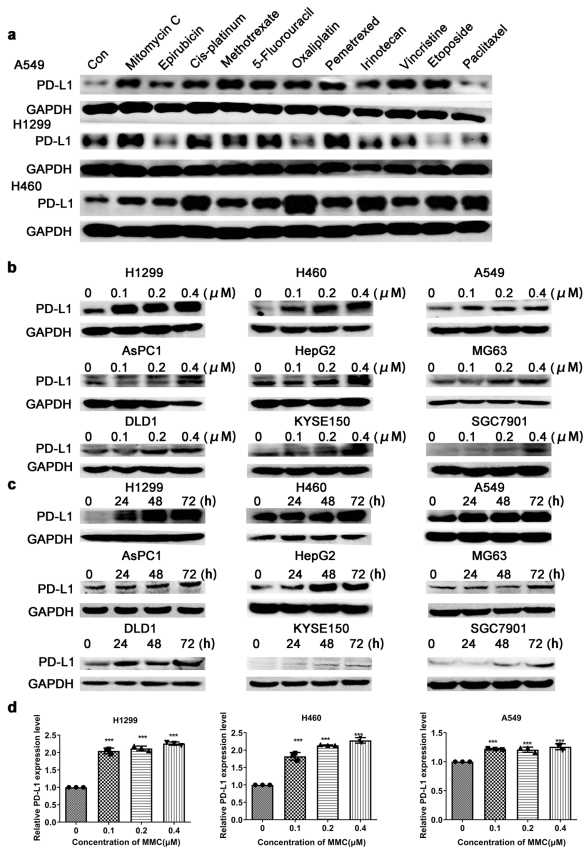
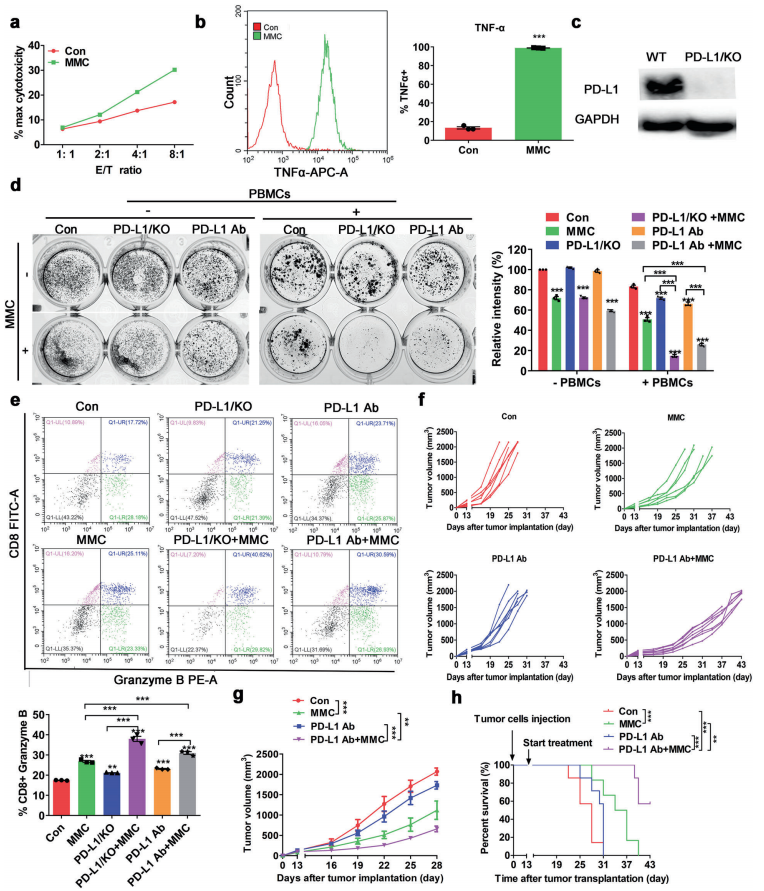
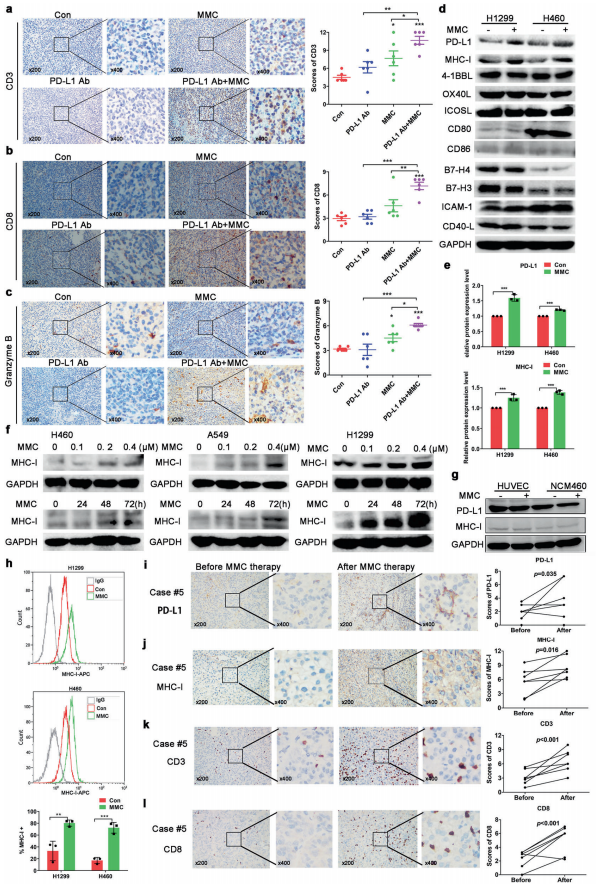
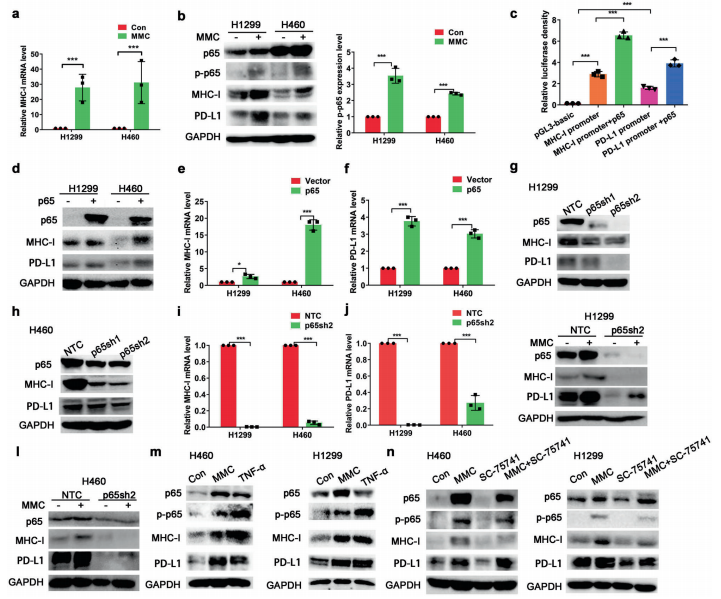
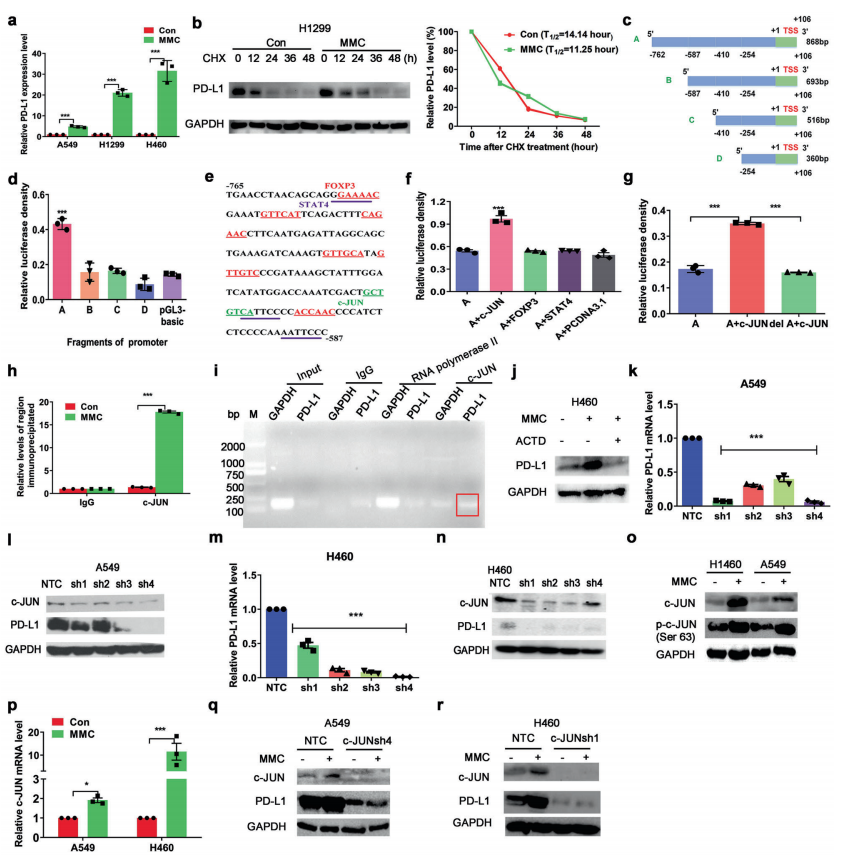
人体利用T细胞通过协调先天和适应性免疫反应,选择性地识别和杀死外部病原体和不健康细胞,包括癌细胞。程序性细胞死亡1(PD-1)受体是活化T细胞表面表达的关键抑制性免疫检查点蛋白。其程序性死亡配体1(PD-L1),又称B7-H1,常见于多种细胞类型,包括T细胞,B细胞,单核细胞,抗原递呈细胞((APC)和上皮细胞。癌细胞可以通过利用各种免疫检查点来逃脱免疫检测和消除。在各种实体肿瘤或肿瘤微环境中的非转化细胞中具有PD-L1的过度表达现象。肿瘤细胞表面的PD-L1和活化T细胞上的PD-1受体的相互作用可以抑制细胞毒性T细胞。一直以来,PD-L1在肿瘤中的高度表达与癌症患者的不良临床预后也密切相关。随着癌症免疫治疗的发展,阻断剂PD-L1/PD-1相互作用或下调PD-L1在癌细胞中的表达可以增强抗肿瘤免疫活性以及抑制肿瘤生长已引起广泛关注。最近一些针对PD-1/PD-L1的免疫治疗药物,包括纳武利尤单抗、阿替唑利单抗等,得到了美国食品和药物管理局的批准,这些药物彻底改变了癌症患者包括PD-L1高度表达的非小细胞肺癌(NSCLC)的治疗。 众所周知,各种经典的化学治疗药物除了对癌细胞的直接细胞毒性作用外,还可以通过改变肿瘤的微环境来激活免疫反应。据报道,环磷酰胺可以减少疫苗模型以及临床前过继性T细胞中的调节性T细胞(TReg),这可能会加强患者的免疫治疗。其他一些可以减少髓源性抑制细胞(MDSCs)的细胞毒性化学治疗药物,例如5-氟尿嘧啶、吉西他滨和紫杉烷类也已被报道。另外,在报道中一些化疗方案可以通过改变免疫系统来增强免疫检查点阻断剂的抗癌反应。组蛋白去乙酰化酶抑制剂与CTLA-4或PD-1阻滞剂协同作用,可以根除小鼠模型中的原发肿瘤和其转移。此外,新辅助化疗能刺激肿瘤浸润淋巴细胞(TILs),并上调肿瘤患者肿瘤细胞PD-L1的表达也已得到证明。因此,以这些具有免疫刺激特性的化疗药物作为候选药物,增加癌细胞的免疫原性,并随后扩大抗PD-L1治疗的好处是十分可取的。 在本研究中,符立梧教授课题组评估了几种常规化疗药物对非小细胞肺癌细胞PD-L1表达的影响。丝裂霉素(MMC)与PD-L1抗体在体内外均具有协同作用。与单药治疗相比,MMC+PD-L1抗体联合治疗能有效增加肿瘤浸润淋巴细胞(Til)数量,促进T细胞分泌细胞毒血清蛋白酶诱导靶细胞凋亡。此外,联合治疗也能提高NSCLC细胞中MHC-I的表达。通过MMC处理后的肿瘤组织中Til显著增加,PD-L1和MHC-I水平升高,也证实了体外研究结果。从机理上来讲,MMC能够激活ERK通路,随后促进c-JUN与PD-L1启动子的结合,并募集其辅助因子STAT3加强PD-L1的表达。此外,ERK通路的上调也可以通过激活p65来增加MHC-I的表达。综上所述,这是首次对经典化疗药物MMC针对PD-L1检查点抑制剂在NSCLC中抗肿瘤作用的影响进行系统探究。该研究成果已发表在Signal Transduction and Targeted Therapy期刊上,IF=13.493。博士后罗敏为第一作者,符立梧教授为该文章的通讯作者。 基本信息 题目: Mitomycin C enhanced the efficacy of PD-L1 blockade in non-small cell lung cance 期刊:Signal Transduction and Targeted Therapy 影响因子:13.493 PMID:32855386 通讯作者:符立梧 作者单位:中山大学肿瘤防治中心等 索莱宝合作产品: 产品名称 产品货号 Lactate Dehydrogenase (LDH) Assay Kit 研究背景及摘要 程序性死亡配体1(PD-L1)免疫检查点抑制剂对于肿瘤治疗具有广泛的应用前景,但其有效率<20%。而一些化疗药物可以激活抗癌免疫反应来杀死癌细胞同时还具有直接的细胞毒性。作者这项研究旨在于探讨将化疗药物与PD-L1抗体联合应用以达到提高PD-L1阻断剂灵敏度的效果。作者将采用丝裂霉素C(MMC)预处理的非小细胞肺癌(NSCLC)细胞与外周血单个核细胞(PBMCs)共同培养,用于探究MMC与PD-L1抗体联合作用的效果。这组联合药物的疗效也在C57BL/6小鼠体内的Lewis肺癌(LLC)细胞中进行了研究。结果表明MMC可增强体内外NSCLC细胞中PD-L1和MHC-I的表达,增强淋巴细胞对NSCLC的细胞毒作用。在载有LLC的小鼠模型中,MMC和PD-L1抗体联合应用比单独应用时更能有效地抑制肿瘤生长以及延长总生存率,这一现象与淋巴细胞浸润和颗粒酶B释放的增加有关。从机制上来讲,MMC激活ERK通路,随后增强c-JUN与PD-L1启动子的结合,并通过募集其辅因子STAT3以增加PD-L1的表达。上调的ERK通路也通过激活的p65强化了MHC-I的表达。MMC可以增强PD-L1阻断剂对NSCLC细胞的作用。进一步将研究结果转化为临床应用的研究也是十分必要的。 研究内容及结果 1. MMC处理后肿瘤细胞PD-L1表达上调 在非细胞毒性浓度下使用几种常规化疗药物将三种NSCLC细胞(A549、H1299和H460)处理48h后,对细胞中PD-L1的表达结果进行评估。结果发现MMC在三种NSCLC细胞中均能够使PD-L1的表达持续增加。为了验证MMC对PD-L1的上调是否是一种普遍现象,在不同癌症类型的更多癌细胞中,对不同浓度和时间的MMC处理进行了探究。在NSCLC和所有测试的癌细胞中,MMC对PD-L1表达的显著上调呈现出了对MMC处理浓度和时间的相关性。 2. PD-L1阻断剂和MMC的结合产生协同抗肿瘤作用 为了确定MMC上调PD-L1表达是否会影响抗肿瘤免疫活性,用MMC预处理H460细胞24h,然后与PBMC共培养24h。结果表明与未用MMC预处理的细胞相比,用MMC预处理的H460细胞细胞裂解数量更多。此外,MMC预处理且PBMCs孵育后的H460细胞CD3+T细胞群体中TNF-α水平明显升高。这些结果表明,MMC增强了T细胞的活化。为了验证PD-L1参与MMC和PD-L1联合阻断的增强抗癌作用,作者建立了稳定的PD-L1敲除的PD-L1/KO-H460细胞。通过对PD-L1抗体处理后的Giemsa染色,将进行或未进行MMC预处理过的PD-L1/KOH460细胞和野生型对照H460细胞中T细胞介导的肿瘤细胞杀伤力进行了探究。在野生型H460和PD-L1/KO H460细胞中,MMC和PD-L1抗体的联合作用均明显高于MMC或PD-L1抗体,而在PD-L1/KO H460细胞中观察到了更明显的效果。颗粒酶B是一种丝氨酸蛋白酶,可介导细胞毒性T淋巴细胞的凋亡作用。重要的是,与未预处理的H460细胞相比,MMC预处理且PBMC孵育后H460细胞的CD8+释放出更多的颗粒酶B。为了探究MMC和PD-L1抗体在体内的联合抗癌作用,在C57BL/6小鼠侧翼建立Lewis肺癌模型。当肿瘤体积达到100mm3时,随机的将小鼠进行MMC单独处理,PD-L1抗体单独处理,MMC与PD-L1联合抗体、生理盐水+同型对照IgG腹腔注射处理。与IgG治疗的对照组和其他单药组相比,MMC和PD-L1联合抗体可使得肿瘤生长更加延缓。MMC和PD-L1联合抗体也是四个处理组中存活率最佳的。 3. MMC增加了MHC-I在肿瘤组织中的表达 为了探讨经PD-L1抗体处理后MMC对T细胞反应的增强作用,测定了C57BL/6肿瘤组织中肿瘤浸润T细胞的数量及其活性。免疫组化染色显示,MMC和PD-L1抗体联合处理后CD3+和CD8+T细胞浸润肿瘤的数目明显高于两个单一处理。另外,在联合抗体处理组中T细胞活化标记颗粒酶B也明显增加。为了探讨TILs增加的机理,作者检测了几种参与T细胞活化的共刺激或共抑制分子。肿瘤细胞能够通过下调I类主要组织相容性复合物(MHC-I)的表达来逃避细胞毒性T细胞介导的特异性免疫反应,这对于识别和随后的杀伤效果是必需的。为此,MMC处理48h后,NSCLC细胞中PD-L1的上调伴随着MHC-I的表达增加。事实上,MMC也被发现NSCLC细胞中MHC-I的表达与MMC处理浓度和时间的增加具有相关性。然而,作者检测了MMC处理后PD-L1和MHC-I在两个正常细胞(HUVEC(人脐静脉内皮细胞)和NCM460(正常来源的结肠粘膜细胞))中的表达。结果表明PD-L1和MHC-I的表达都没有受到MMC的影响。MHC-I在H1299和H460细胞表面的表达被MMC提高。为了进一步证实这一结果,作者对MMC处理前后患者肿瘤标本中TILs的改变进行了研究。结果表明MMC处理后肿瘤组织PD-L1和MHC-I的表达升高。而在MMC处理后,肿瘤组织中CD3+和CD8+浸润淋巴细胞的数量也明显增加。 4. MMC通过激活p65增加MHC-I的表达 用MMC(0.4μM)处理48h的NSCLC细胞(H1299和H460)中MHC-I mRNA水平显著升高。转录因子NF-κB是细胞对炎症刺激反应的的重要介质。为此,NF-κB p65能够对MHC-I和PD-L1的表达进行调控已被报道。作者探究了MMC处理48h后NSCLC细胞NF-κB p65亚单位表达的影响。结果表明MMC处理后,p65及其磷酸化形式p-p65均增加。荧光素酶报告试验数据表明,p65显著上调了MHC-I和PD-L1启动子驱动的荧光素酶活性。此外,p65的过表达可提高NSCLC细胞中MHC-I和PD-L1的mRNA和蛋白水平。另一方面,p65压制也降低了MHC-I和PD-L1的蛋白表达。为了研究p65对于MMC诱导的MHC-I和PD-L1上调来讲是否是必需的,对p65敲除后的H1299或H460细胞采取MMC处理,然后观察MHC-I和PD-L1的蛋白表达。结果表明虽然在对照细胞中MMC能够诱导p65、MHC-I和PD-L1的表达,但p65的敲除可以减弱MMC对MHC-I和PD-L1的上调的诱导。NF-kB/p65转录的激活需要TNF-α。为了验证MMC诱导的MHC-I和PD-L1上调与p65是否激活的关系,采用MMC或TNF-α处理H460/H1299细胞,检测处理后细胞中MHC-I和PD-L1的p65磷酸化和表达。结果发现SC-75741(一种阻止p65转录活性的抑制剂)能够抑制MMC对H1299和H460中MHC-I表达。相反,在SC-75741存在下,MMC对PD-L1表达的上调没有影响,表明MMC诱导PD-L1表达的上调与p65的转录活性无关。 5. c-JUN的激活使得MMC增加PD-L1的表达 经过MMC处理48h后,NSCLC细胞(A549、H1299和H460)中PD-L1 mRNA水平显著升高。在H1299细胞中PD-L1蛋白稳定性且不受MMC处理的影响。为了研究MMC对PD-L1的转录调控,对具有pGL3-碱性荧光素酶结构的293T细胞进行了荧光素酶报告基因检测,该结构含有4个不同的进行性5’缺失的PD-L1启动子区域。最长的PD-L1启动子序列(p868)在四个启动子区中表现出最高的荧光素酶活性。这一发现表明,PD-L1启动子区域内的核心元素(−762至−587bp)是驱动转录和观察荧光素酶活性的关键。根据PROMO和JASPAR数据库预测少数候选转录因子(包括c-JUN、STAT4和FOXP3)与核心PD-L1启动子元件结合,驱动基因转录。为了进一步证实与PD-L1核心启动子结合并驱动其转录的转录因子(S)的同一性,将表达载体(pCDNA3.1/c-JUN、STAT4或FOXP3)转染293T细胞,用含有核心PD-L1启动子区的荧光素酶构建物(−762至−587bp)重复荧光素酶报告基因检测。结果发现只有pCDNA3.1/c-JUN具有激活PD-L1启动子驱动的荧光素酶活性。此外,当从PD-L1启动子核心启动子区(DeltA)中删除c-JUN结合位点时,PD-L1启动子驱动的荧光素酶活性下降到基线水平。在H460细胞中进行CHIP检测,使用抗c-JUN抗体对PD-L1染色质进行免疫沉淀,发现MMC处理后c-JUN与核心PD-L1启动子区域的关联显著增加。采用同型对照兔IgG作为阴性对照进行免疫沉淀。为了证明CHIP检测的特异性,对c-JUN和RNA聚合酶II与组成型GAPDH启动子的结合与核心PD-L1启动子进行分析。使用正常IgG时,未从免疫沉淀样品中获得PCR信号。用RNA聚合酶II插入染色质检测RNA聚合酶II与GAPDH和PD-L1启动子的结合时,发现c-JUN是与免疫沉淀染色质中的核心PD-L1启动子特异性结合的。研究表明转录抑制剂放线菌素D能够抑制MMC对PD-L1上调的诱导。因此,c-JUN与PD-L1基因启动子结合很可能使得PD-L1表达的转录性上调。为了证实c-JUN作为转录因子起到调节NSCLC细胞中PD-L1基础表达的作用,作者将shRNAs敲除c-JUN。在c-JUN基因敲除的肿瘤细胞中,mRNA和PD-L1蛋白水平均显著降低。作者通过检测处理48h后的A549和H460细胞中c-JUN的表达,进一步探讨了c-JUN在MMC介导的PD-L1表达上调中的作用机理。发现通过MMC处理,mRNA和c-JUN蛋白水平均显著升高。在MMC处理后,激活形式的磷酸盐也显著增加。在c-JUN-敲除的NSCLC细胞(A549和H460)中,MMC对PD-L1上调的诱导消失。 6. C-JUN与它的辅助因子STAT3协调作用使得PD-L1上调 在之前的研究报道中,c-JUN与STAT3相互作用形成一个复合物来调节其靶基因的表达。为了研究STAT3是否参与了MMC诱导的PD-L1上调,检测在MMC处理后的H1299和H460细胞中STAT3的表达。MMC可提高NSCLC细胞中的mRNA和STAT3蛋白水平。在STAT3敲除的细胞中MMC对PD-L1表达的诱导消失。与这个发现一致的是,在硝呋酚酰肼(一种阻止STAT3激活的抑制剂)的存在下,MMC未能上调NSCLC细胞中PD-L1的表达。当p-c-JUN和p-STAT3被转运到细胞核以发挥其转录活性时,来自MMC处理或未处理的H460细胞中的细胞核和细胞质组分被分离和检测。MMC处理后PD-L1细胞质表达升高的同时,细胞质和核中c-JUN和p-c-JUN表达升高。另一方面,在细胞核中STAT3(p-STAT3)的转录活性也上调。另外,MMC处理后H460细胞中c-JUN与STAT3的相互作用增强。表明MMC能调节c-JUN和STAT3的表达和相互作用,从而上调PD-L1在体外的表达。 7. MMC通过ERK信号诱导MHC-I和PD-L1表达 MMC通过激活ERK PD-L1和MMC刺激MHC-I和PD-L1的表达主要通过两个主要机制控制,即IFN-γ依赖和独立的方式。为了验证IFN-γ信号是否参与了MMC对PD-L1表达的上调,对转染对照shRNA或IFNGR1 shRNA的A549和H460细胞进行或不进行MMC处理。在MMC处理后的对照和IFNGR1基因敲除的细胞(A549和H460)中PD-L1、c-JUN、STAT3的表达及其膦酸盐形式均增加。另一方面,虽然IFN-γ能够显著增加PD-L1的表达,但这种作用在IFNGR1基因敲除细胞中消失。因此,MMC处理后PD-L1的增加是由c-JUN/STAT3信号通路介导的,而不是通过IFN-γ依赖性的方式介导的。据报道,MMC通过ERK和JNK信号增加了c-JUN的活性。此外,p65是MAPK通路激活的下游转录因子。因此,MMC对p-ERK1/2和p-JNK蛋白水平存在影响。在H1299和H460细胞中,MMC均使得ERK和JNK的磷酸化升高。为了进一步阐明ERK和JNK信号的参与,研究了MEK抑制剂(U0126)或JNK抑制剂(SP600125)对MMC诱导的PD-L1和MHC-I表达上调的影响。虽然MMC诱导PD-L1和MHC-I表达不受SP600125的影响,但U0126显著降低了MMC对PD-L1和MHC-I表达上调的诱导。这些发现表明ERK通路的激活在MMC上调NSCLC细胞中MHC-I和PD-L1中起着至关重要的作用。 研究结论和意义 在本研究中,MMC可上调NSCLC中PD-L1和MHC-I的表达,增强PD-L1阻断剂在体外和体内的疗效,这与肿瘤肿块中TILs的增加以介导抗肿瘤免疫有关。c-JUN的激活和c-JUN与STAT3之间的相互作用增加均通过ERK信号介导PD-L1表达的上调。另一方面,p65的激活也会使得MHC-I增加。综上所述,本研究倡导将PD-L1抗体与MMC进行结合以提高PD-1/PD-L1免疫治疗NSCLC的治疗效果。 索莱宝产品亮点 LDH assay in H460 cells pretreated with MMC(0.4 μM, 24 h). Effector cell (E): PBMC Target cell (T): H460 相关产品 产品名称 产品货号 Hexokinase(HK) Activity Assay Kit Hexokinase(HK) Activity Assay Kit Pyruvate Kinase(PK) Activity Assay Kit Pyruvate Kinase(PK) Activity Assay Kit Phosphoenolpyruvate Carboxylase (PEPC) Activity Assay Kit Phosphoenolpyruvate Carboxylase (PEPC) Activity Assay Kit Pyruvate(PA) Content Assay Kit Pyruvate(PA) Content Assay Kit Glyceraldehyde-3-phosphate Dehydrogenase(GAPDH) Activity Assay Kit Glyceraldehyde-3-phosphate Dehydrogenase(GAPDH) Activity Assay Kit Lactic Acid(LA) Content Assay Kit Lactic Acid(LA) Content Assay Kit Phosphoglycerate Kinase(PGK) Activity Assay Kit Phosphoglycerate Kinase(PGK) Activity Assay Kit Fructose-bisphosphate aldolase(FBA) Activity Assay Kit Fructose-bisphosphate aldolase(FBA) Activity Assay Kit Fructose-1,6-diphosphate(FDP) Assay Kit Fructose-1,6-diphosphate(FDP) Assay Kit Lacate Dehydrogenase(LDH) Activity Assay Kit Lacate Dehydrogenase(LDH) Activity Assay Kit

文献解读|丝裂霉素C强化PD-L1阻断剂对非小细胞肺癌的治疗效果
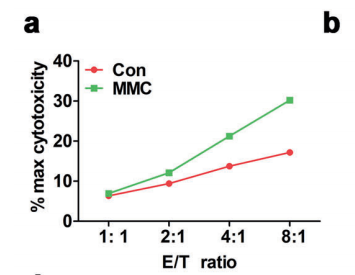
作者:北京索莱宝科技有限公司 2021-02-26T09:49 (访问量:8677)
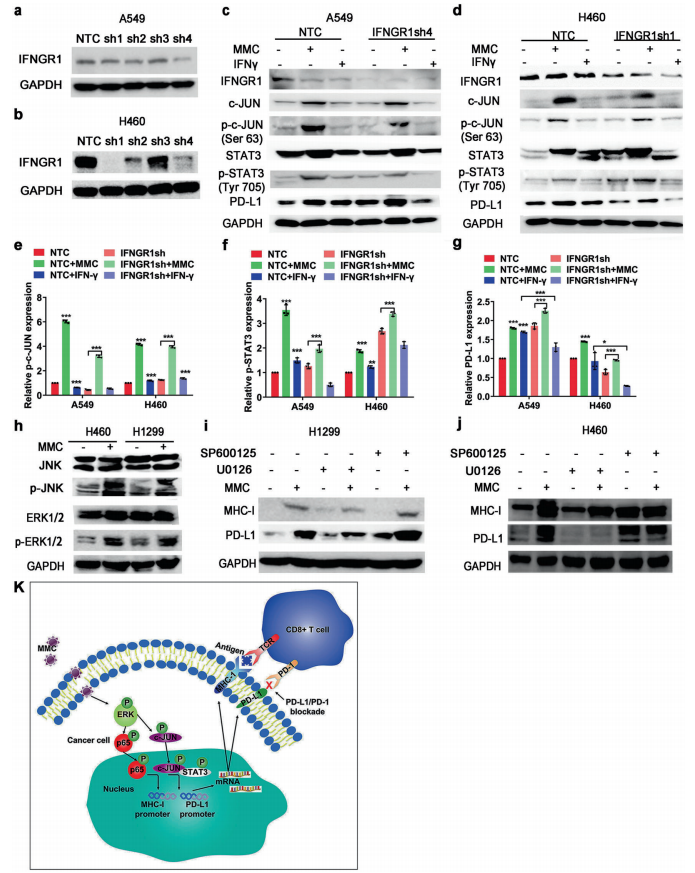
北京索莱宝科技有限公司 商家主页
地 址: 北京市北京经济技术开发区环科中路16号26幢3层301
联系人: 索莱宝-龚思雨
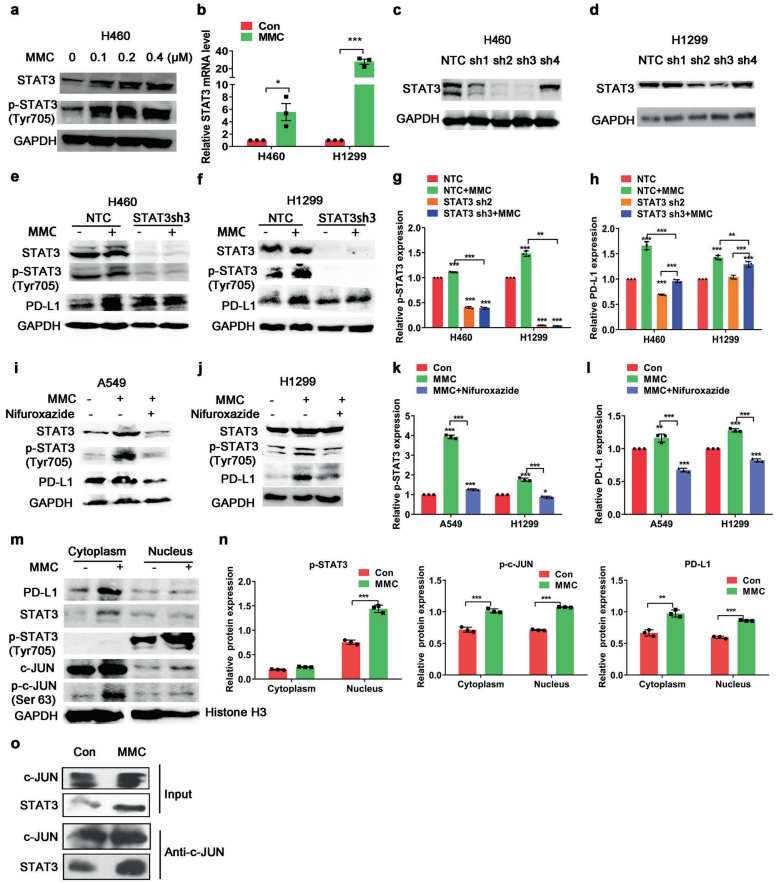
电 话: 010-50973130
传 真:
Email:3193328036@qq.com
相关咨询
文献解读|基于病毒仿生纳米技术的淋巴结-肿瘤双靶向STING激活疫苗及其癌症免疫治疗应用 (2025-09-19T00:00 浏览数:7207)
靶标解读HMGB1 (2025-09-19T00:00 浏览数:7082)
稳定同位素标品还没选够?定制服务来了!你的专属标记物,按需打造! (2025-09-19T00:00 浏览数:6579)
花香蝶自来 ¦ Solarbio小分子化合物“优秀员工展”第十九期 (2025-09-19T00:00 浏览数:6132)
智慧星芒,汇聚脑海|索莱宝邀您相约CNS2025,共探神经科研之旅 (2025-09-19T00:00 浏览数:7529)
Solarbio Will Wait for You in ARAB LAB 2025 [Dubai] (2025-09-19T00:00 浏览数:5790)
文献解读|基于微流控技术和迁移学习的复杂组织高分辨率空间分辨蛋白质组学研究 (2025-09-19T00:00 浏览数:7202)
THP-1成巨噬细胞诱导分化试剂盒 (2025-09-19T00:00 浏览数:5651)
BCEIA2025|索莱宝邀您共聚beijing,分析科学前沿 (2025-08-29T00:00 浏览数:16150)
色谱“缉拿”指南:Solarbio专业猎手,让目标物质无处遁形! (2025-08-29T00:00 浏览数:14206)
