RNA提取及检测
核糖核酸(缩写为RNA,即Ribonucleic Acid),存在于生物细胞以及部分病毒、类病毒中的遗传信息载体。通常在细胞进行转染后,需要进行RNA水平及蛋白水平的检测。
RNA的检测即RT-qPCR,包括三大步骤:RNA的提取与浓度测定、逆转录为cDNA、以及实时荧光定量PCR实验。通过RT-qPCR实验,可以分析目的基因的转录水平。
RNA提取是RT-qPCR实验成功的首要步骤,RNA的质量直接决定RT-qPCR的结果。在实验中我们需要注意由于RNA分子结构不稳定和周围环境中无处不在的RNase对RNA降解造成的威胁。
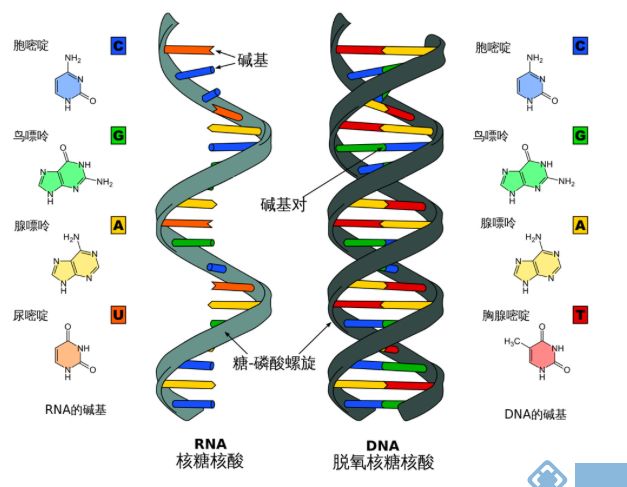
图1 RNA和DNA
RNA提取及浓度测定
1.样本
选择生长旺盛期的细胞,如果对细胞进行处理,一般选择处理后48h左右的细胞;如果是组织样本,也尽量选择新鲜、生长旺盛的组织样本。
2.样本的收集及保存
获取样本后,最好立即提取RNA。如果细胞不能及时处理则保存于Trizol裂解液中;如果遇到不能立即处理的组织样本,则需要将组织剪成小组织块,在液氮中速冻1h以上,之后保存于-80℃冰箱。
3.RNA提取注意事项
避免环境中RNase的污染: 实验台面需要用75%的酒精擦拭干净,操作过程需要佩戴口罩、帽子和手套等; 需要准备RNase-free的耗材。
4.常见的RNA提取方法
i沉淀法
Trizol裂解液是总RNA提取的常用试剂, 内含苯酚、异硫*酸胍等物质,能迅速破碎细胞,释放核酸,并抑制细胞释放的核酸酶。
1)组织中提取RNA: 第一步需要液氮研磨,将组织块放入研钵中,加入少量液氮,迅速研磨,待组织块变软,再次加入液氮研磨,反复三至四次后加入50-100mg/ml的Trizol,转入离心管中,室温放置10min,使其充分裂解。12000rpm,离心5min,弃掉沉淀。细胞中提取RNA:根据细胞量加入对应的Trizol,在摇床放置10-15min后,收集到离心管中。
2)按照200ul氯仿/ml Trizol加入离心管中,混匀后室温放置10min(切勿用涡旋振荡仪,防止基因组DNA断裂)。
3)4℃,12000rpm,离心15min。
4)将上层水相转移到新的离心管中,按照500ul异丙醇/ml Trizol加入离心管中,室温放置10min。
5)4℃,12000rpm,离心15min。
6)按照1ml 75%无水乙醇/ml Trizol,加入到离心管中,4℃,12000rpm,离心10min清洗一次RNA沉淀,室温放置5min左右晾干(RNA不可过于干燥,否则很难溶解)。
7)加入适量DEPC水溶解RNA,在Nanodrop上测定RNA浓度。
ii试剂盒法
主要是利用离心柱法提取RNA,具体可根据各试剂盒的说明书进行提取。主要利用高盐吸附、低盐洗脱的原理,在于操作简单,耗时短,RNA完整性好,但是有的试剂盒浓度、纯度略低于沉淀法。
逆转录PCR
不同RNA逆转为从cDNA的效率不同,因此选择合适的逆转录试剂盒很重要。逆转录试剂盒通常包括逆转录酶、dNTP、引物等。
i逆转录酶
目前市场上有两种不同的逆转录酶,一种来自纯化的禽成髓细胞瘤病毒(AMV),由两条肽链组成,具有聚合酶活性和很强的RNA酶活性,它最适温度是42 ℃,最适pH 8.3。但是高水平的RNA酶活性既抑制cDNA产生也限制其长度。
另一种来源于鼠白血病病毒(Mo-MLV)的逆转录酶,是单肽链的,有RNA聚合酶活性和相对较弱的RNA酶活性,最适温度37 ℃,最适pH 7.6,较弱的RNA酶活性,可扩增2-3 kb的cDNA。
ii dNTP
四种脱氧核苷三磷酸(dNTP)的浓度,对于有效合成cDNA是至关重要的。如果其中只有一种的浓度小于10-50 μM,cDNA的产量将明显下降。常用的dNTP的浓度为200-500 μM。
iii 引物
逆转录引物一般包含三种:oligo dT,Random Primer Mix和特异性引物。客户可以根据个人需求进行选择。Oligo-dT引物对于大多数应用是首选的,因为它确保所有cDNA拷贝终止于mRNA的3' 末端并可获得最高产量的全长cDNA。
逆转后的cDNA不需要用Nanodrop来检测浓度与纯度,因为逆转录后的产物是一个混合体系(含有cDNA、未完全逆转录的RNA、dNTP、残余的引物以及各种蛋白和盐离子等成分),会干扰cDNA的吸光度。此外,260 nm是核酸吸收峰最高的位置,在这个位置,1 OD(optical density,光密度)的吸光度分别相当于50 ng/μL的双链DNA,37 ng/μL的单链DNA,40 ng/μL的RNA,30 ng/μL的寡核苷酸(dNTP)。例如,就dNTP而言,即使cDNA浓度一样,但dNTP也会严重干扰其测定结果。
实时荧光定量PCR
在PCR反应体系中加入荧光基团,利用荧光信号的变化实时检测PCR扩增反应中的每一个循环中产物的变化,通过CT值和标准曲线的分析对起始模板进行定量分析的一项技术。
CT值:qPCR扩增过程中,扩增产物的荧光信号达到设定的荧光阈值时对应的扩增循环数(cycle Threshold)。CT值与模板的起始拷贝数的对数存在线性关系。
基线:在PCR反应的最初的几个循环里,荧光信号变化不大,接近一条直线,这样的直线即为基线。
扩增曲线:粗略来判断扩增效率。
判断扩增曲线是否良好的几个指标:
1.曲线拐点清楚;
2.曲线指数期斜率与扩增效率成正比,斜率越大扩增效率越高;
3.标准的基线平直,无明显上扬趋势;
4.各扩增曲线平行性好。
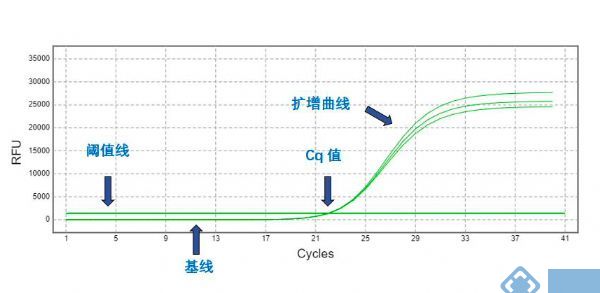
图2 qPCR扩增曲线
Real-time qPCR 的种类:一类为探针类,包括TaqMan®探针和分子信标,利用与靶序列特异杂交的探针来指示扩增产物的增加。一类为非探针类,其中包括如 SYBR® Green I 或者特殊设计的引物(如 LUX®Primers) 通过荧光染料来指示产物的增加。
Taqman®探针是最早用于定量的方法。就在 PCR 扩增时加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸:5’端标记一个荧光报告基团 ,3’端标记一个荧光淬灭基团。探针完整时,报告基团发射的荧光信号被淬灭基团吸收,也就是 FRET 反应; PCR 扩增时,Taq 酶的 5'-3'外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离 ,从而荧光监测系统可接收到荧光信号,即每扩增一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与PCR 产物形成完全同步。而新型 TaqMan-MGB 探针使该技术既可进行基因定量分析,又可分析基因突变(SNP), 有望成为基因诊断和个体化用药分析的首选技术平台 。
图3 TaqMan探针原理
SYBR® Green I 是一种结合于小沟中的双链 DNA 结合染料,与双链 DNA结合后,其荧光大大增强。这一性质使其用于扩增产物的检测非常理想。SYBR®GreenI 的最大吸收波长约为 497nm ,发射波长最大约为 520nm。在 PCR 反应体系中,SYBR® Green 荧光染料特异性地掺入DNA 双链后,发射荧光信号,从而保证荧光信号的增加与 PCR 产物的增加完全同步。
图4 SYBR Green染料原理
熔解曲线
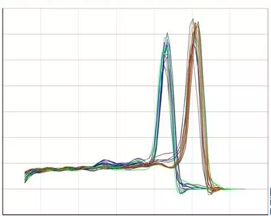
熔解曲线分析可以用来确定不同的反应产物,包括非特异性产物。熔解温度上有一特征峰(Tm,DNA双链解链50%的温度),用这个特征峰就可以将特异产物与其它产物如引物二聚体区分开。
图5 qPCR熔解曲线
品牌 | 货号 | 中文名 |
JSENB | ES427039 | 无水乙醇 |
JSENB | JS0020 | 8-羟基喹啉 |
JSENB | JS0332 | 无菌水 |
JSENB | JS0083 | EDTA 游离酸 |
JSENB | JS0030 | 甲叉双丙烯酰胺 |
新冠病毒核酸检测原理
(2022-06-30T10:41 浏览数:45353)
专业承接合成定制,清华博后团队品质保证
(2022-06-09T11:20 浏览数:69483)
专业承接合成定制,清华博后团队品质保证
(2022-06-07T14:52 浏览数:62250)
摩莱检测,您的检测好帮手!
(2022-06-07T14:43 浏览数:57356)
摩莱检测,您的检测好帮手!
(2022-06-09T10:57 浏览数:71134)
河北品科研生物科技有限公司2022年春季招聘
(2022-06-07T14:05 浏览数:31484)
品科研招募代理
(2022-06-09T10:49 浏览数:68989)